|
|
氧化铁红 |
| CAS No.: |
1332-37-2 |
| 分子式: |
|
| 分子量: |
74.92 |
| 备注: |
中文名称氧化铁中文同义词氧化铁;氧化铁1UM100G;氧化铁红;氧化铁/纳米氧化铁醇分散液;氧化铁1UM;纳米氧化铁/铁醇分散液;氧化铁红色素;食用氧化铁红英文名称Ironoxide英文同义词AM125;AncorFR;AncorFY;AuvicoAX1000;AX1000;BUS;EP-A0014382;NanoironoxideusedinInkCAS号1332-37-2分子式Fe2O3分子量159.69EINECS号215-570-8相关类别有机化工原料类;助剂;着色剂;食品添加剂;化工产品-有机溶剂;生化试剂;稀土;塑料制品橡胶制品;化工原料;助剂;UVCBs-inorganic;dyestuff;化工;氧化铁红;无机盐;常规氧化物粉体-三氧化二铁;化工产品;原料;氧化物-三氧化二铁;医药原料药;化工材料;无机化工原料;基本原料;氧化物Mol文件1332-37-2.mol结构式氧化铁性质密度2.66g/cm3储存条件-70°C溶解度酸水溶液(微溶)形态固体颜色黑色生物来源human介电常数14.2(0.0℃)InChIInChI=1S/2Fe.3O/q2*+3;3*-2InChIKeyLIKBJVNGSGBSGK-UHFFFAOYSA-NSMILES[Fe+3].[Fe+3].[O-2].[O-2].[O-2]EPA化学物质信息Ironoxide(1332-37-2)氧化铁用途与合成方法物理性质氧化铁有天然的和人造的两种。天然的称西红,是基本上纯粹的氧化铁,为红色粉末。由于生产方法和操作条件的不同,它们的晶体结构和物理性状都有很大的差别,色泽变动于橙光到蓝光至紫光之间。遮盖力和着色力都很大。密度5-5.25。有优越的耐光、耐高温性能,并耐大气影响、耐污浊气体、耐一切碱类。只有在浓酸中加热的情况下才会逐渐溶解。基本性能外观:橙红至紫红色的三方晶系粉末。氧化铁有天然的与合成的2种。天然的称作西红,相对密度55.25。细度0.4~20um。熔点1565(分解)。灼烧时放出氧气,能被氢和—氧化碳还原成铁。不溶于水,溶于盐酸、硫酸,微溶于硝酸和酵类。氧化铁具有优异的耐光、耐高温、耐酸、耐碱、防锈性。分散性好,着色力和遮盖力很强,无油渗性和水渗性。无毒。空气中最高容许浓度为5mg/m3。氧化铁是仅次于钛白的第二大无机颜料,也是第一大彩色无机颜料。氧化铁颜料主要指以铁的氧化物为基本物质的氧化铁红、铁黄、铁黑和铁棕四类着色颜料,其中以氧化铁红为主(大约占到氧化铁颜料的50%),用作防锈颜料的云母氧化铁以及用作磁性纪录材料的磁性氧化铁也属于氧化铁颜料的范畴。化学参数▼▲详细说明指标HO01-04HO01-02130190103、104混酸法硫酸法硝酸法混酸法铁含量,以Fe2O3(105℃烘干)表示,%(m/m)≥95949595105℃挥发物,%(m/m)≤1.01.01.01.0水溶物,%(m/m)≤0.30.30.30.3水溶性氧化物及盐,以C1和SO1表示,%(m/m)≤0.20.20.20.2筛余物(63um网眼),%(m/m)≤0.30.30.30.3水萃取液酸碱度,ml≤20202020水悬浮液Ph值5~75~75~75~7吸油量,g/100g15~2515~2515~2515~25铬酸铅阴性阴性阴性阴性总钙量,以CaO表示,%(m/m)≤0.30.30.30.3颜色1)、2)(与标准样比)95959595相对着色力1)(与标准样比),%≥近似~微近似~微近似~微近似~微有机着色物的存在阴性阴性阴性阴性色光红黄色浅红色-紫红色桔红色枣红色主要用途在建材工业中氧化铁主要用于彩色水泥、彩色水泥地砖、彩色水泥瓦、仿琉璃瓦、混凝土地砖、彩色灰浆、彩色沥青、水磨石、马赛克花砖、人造大理石及墙面粉刷等;用于各种涂料着色和保护物质,包括水性内外墙涂料、粉末涂料等;也可适用于油性漆包括环氧、醇酸、氨基等各种底漆和面漆;也可用于玩具漆、装饰漆、家具漆、电泳漆和磁漆。铁红底漆具有防锈功能,可以代替高价的红丹漆,节约有色金属。用途用于塑料制品的着色,如热固性塑料和热塑性塑料,及橡胶制品的着色,如汽车内胎,飞机内胎,自行车内胎等。用于高级精磨材料,使用于精密的五金仪器、光学玻璃等的抛光。高纯度的是粉末冶金的主要基料,用来冶炼各种磁性合金和其他高级合金钢。由硫酸亚铁或氧化铁黄或下脚铁混经高温煅烧而得,或直接从液体介质中制成。制造方法可分为干法和湿法两大类。(1)湿法1)混酸法。主要原料是硝酸、硫酸和铁皮,后者是工业加工铁皮的边角料或机床加工后的废铁屑。生产过程分为晶种制备和铁盐氧化两步,晶种由硝酸和铁皮反应制取。A.反应式:总反应式:带有不定量结晶水的三氧化二铁悬浮体(Fe2O3·nH2O)呈橘红色,作为生产铁红的晶种。在晶种存在下,加入硝酸亚铁溶液与废铁皮,鼓入空气进行氧化。此时,硝酸亚铁溶液中的Fe2+被空气中的氧氧化成氧化铁,沉积在晶种上,同时生成的硝酸与铁皮反应生成硝酸亚铁,其中Fe2+再被氧化,如此不断进行。氧化铁颗粒不断成长,颜色由浅而深,达到所需色泽,氧化过程可终止。其氧化过程的反应式可表示为:在氧化过程中,待料液达发胶阶段,可加入硫酸亚铁溶液补充Fe2+。其反应过程为:氧化结束后,经过筛、过滤、漂洗、干燥,得成品。B.工艺流程:a.硝酸亚铁制备:铁皮经预处理,除去油污、杂质等,放入反应桶①(装满),加水到一定液位(约为容器的1/2容积)。96%的硝酸用水以1:2稀释至32%左右,徐徐加入反应桶内。反应温度不超过60℃,为防止局部过热,引起硝酸分解,反应中要用泵进行料液循环,使料液温度均匀并降低温度。反应终点pH=3~4,硝酸亚铁含量15%左右,然后送澄清桶备用。b.硫酸亚铁制备:在反应桶②中装满铁皮,再加水,然后徐徐加入98%浓硫酸。m(水):m(浓硫酸)=4:1,反应将停止时通蒸汽升温至95℃,使余酸继续反应至pH=4~6结束,FeSO4·7H2O含量达500g/L,移入澄清桶备用。c.晶种制备:在晶种桶内先放水,通入蒸汽加热,同时放入拉松的铁皮(满桶),加入32%的硝酸,V(稀硝酸):V(水)≈1:6。其中约2/3的硝酸在3h内慢慢加入,反应温度在90~95℃,温度变化不要过大,以免晶种老化,活泼性能变差,氧化时收率低而单耗高。在冷却到87℃时,将余下的1/3左右的酸以较快速度加入,待反应趋缓后(约20min后)续加余酸,前后加酸时间共约3.5h。当反应进行到pH=2~3,制得的晶种为色泽呈橘红色浆状,且8h内不沉淀。将晶种与制备好的硝酸亚铁同时加入氧化桶(桶内装满铁皮),晶种液投入量约为氧化桶有效容积的1/3,硝酸亚铁溶液的投加量约为有效容积的1/4,桶内硝酸亚铁的含量约为0.3%~4%。投料后同时通蒸汽和空气,保持氧化温度在80~85℃。当升温到80℃时测定硝酸亚铁的含量应在3%~4%,不足时需补加。氧化48h后,料液中Chemicalbook硝酸亚铁的含量约0.3%,且料液已达到发胶阶段,应立即加硫酸亚铁溶解(FeSO4·7H2O含量为50%),并测定料液中的硫酸亚铁含量在4%~5%左右。继续氧化30h左右,将亚铁含量控制在1%。在此期间应经常补加蒸发掉的水,保持一定液位(离桶口约20cm)。氧化至90h后开始取样检验色光,每4h一次,直到色光接近标准,放料。当色光接近标准,料液中亚铁在0.5%左右时,补加少量15%的硝酸亚铁溶液,以便亚铁溶液耗尽为止准备出料。在氧化过程必须严格控制亚铁[包括Fe(NO3)2和FeSO4]浓度,不允许在反应过程中将Fe2+耗尽,否则色光发暗。氧化过程中尽可能通入大量空气,以保证反应桶中粒子不沉淀并反应充分。氧化桶放出料浆应经筛网过筛,除去未反应的铁屑等,再漂洗、压滤,滤饼在150~200℃下干燥,粉碎为成品。2)硫酸-硫酸亚铁法。用硫酸与铁皮(或铁屑)制备成硫酸亚铁,或用工业副产物硫酸亚铁结晶为原料,采用湿法制取铁红。主要过程是晶种制备和氧化过程。A.反应式:B.工艺流程:基本流程与混酸法相似,示意如下。a.晶种制备:用硫酸亚铁与氢氧化钠反应生成氢氧化亚铁沉淀,在碱性条件下经空气氧化为氢氧化铁,呈红棕色的胶状悬浮体,作为生产氧化铁红的晶种。若硫酸亚铁溶液的浓度过高或氧化时间较长,则晶种较稀薄,晶粒大,形成不了胶态溶液。一般制备成50~60g/LFeSO4·7H2O溶液,pH=2~3,放入晶种桶。在搅拌下加入5%左右的氢氧化钠溶液,氢氧化钠与硫酸亚铁的摩尔比,一般为2~1.1之间,并保持母液中余碱量在0.3~0.5g/L,pH在9~12范围。pH过小和过大都不能形成铁红晶种。在常温下鼓入空气,空气量充足才能得到胶状红棕色晶种,且不易沉降。空气量不足时容易生成铁黑。一般工厂中空气用量在0.7m3/min左右。晶种氧化的反应温度最好在10~20℃,若温度超过40℃,即使适当的pH和空气量也会使晶种变黑(成为Fe3O4),失去载体作用。为了提高晶种稳定性,改善铁红的色光,在晶种制备液中可加入晶型转化的促进剂,使晶格发生变化,粒度分布窄小,这样可使色光纯正。常用的促进剂有碳酸钙、硫酸镁、磷酸盐等,目前用磷酸盐的工厂较多些。在常温下,晶种制备约1~2h即成,然后移入氧化桶。b.氧化过程:在此阶段,硫酸亚铁被氧化成高铁盐,后者水解,再脱水成Fe2O3沉淀于晶种表面,使晶体长大。随着粒子不断增大,颜色会逐渐转成鲜艳而变深,同时水解时生成的硫酸与铁皮作用生成FeSO4,再被氧化成高铁盐而水解。在氧化桶内装满铁皮(或铁屑),铁皮应拉松并去掉杂质,而且属低碳钢的加工废料。加入硫酸亚铁溶液,亚铁含量在50~70g/L。晶种液用稀硫酸中和呈偏酸性pH=6左右,再加入氧化桶。若晶种量过少,铁红形成速度过快,则单位产量偏低,原料消耗增加,且色光进展快,质量不易控制。若晶种量过多,铁红形成速度较慢,则单位产量高些,原料消耗也少些,但氧化后期料浆过分稠厚,将妨碍氧化过程的进行,影响色光的进展。一般晶种加入量为氧化桶有效容积的1/4左右。氧化温度宜保持在80~85℃。若氧化温度偏高,铁红成熟快,产量低,色光偏紫相;若氧化温度偏低,氧化时间长,色光不鲜艳。若空气量大,则反应较充分,单位产量高,颜色较纯正。所以氧化过程中应尽量加大气量,切不能停气。在色光达到与标准样品相似后,停止氧化,经过筛、漂洗、过滤,在150~200℃下干燥,即得成品。(2)干法主要有铁黄粉热分解法、硫酸亚铁热分解法和硫酸亚铁-纯碱法。1)铁黄粉热分解法。将干燥的铁黄粉在煅烧炉(回转炉)中,在500~600℃下煅烧,时间约40~60min,得棕色氧化铁红,经冷却、过筛,即为成品。2)硫酸亚铁热分解法。将硫酸亚铁在转窑或马弗炉中,于700~800℃高温下脱水、氧化煅烧,生成氧化铁,经水洗除去可溶物,再过滤、干燥、粉碎、筛分,得铁红成品。3)硫酸亚铁-纯碱法。硫酸亚铁与碳酸钠在高温下反应,可制得铁红和芒硝。B.工艺流程:将碳酸钠与硫酸亚铁按n(Na2CO3):n(FeSO4·7H2O)=1:1.25混合,磨细后投入焙烧炉,焙烧温度为700℃(温度过高Na2CO3易分解)。焙烧料在室温下用水浸取,使Na2SO4溶解。然后经过滤(滤饼可先用2mol/L的H2SO洗涤,以除去残留的Na2CO3),再用水洗涤,在150~200℃下干燥,即得铁红产品。或滤液经蒸发浓缩后,得NaSO4·10H2O。(3)原料消耗定额,生产1t产品约消耗:▼▲原料硫酸(按100%计)硝酸(100%计)混酸法/t0.080.35硫酸-硫酸亚铁法/t——干法/t——硫酸亚铁(98%FeSO4·7H2O)—0.72.3烧碱(98%)铁皮—0.90.1311.75(碳酸钠)—产品质量标准GB1863—80,代号H101、H102、H103。产品分析(1)Fe2O3含量测定1)重铬酸钾溶液测定法:准确称取已干燥的样品0.2~0.3g(精确至0.0002g),置于500mL锥形瓶中,加1:1盐酸30mL,加热使其完全溶解,并继续加热到微沸;然后滴加20%的氯化亚锡溶液至液体颜色刚变为无色,再多加1滴;加入20mL蒸馏水,冷却至室温。加入2%的氯化汞溶液10mL,摇荡3s,加入硫酸、磷酸混合酸[V(硫酸):V(磷酸):V(蒸馏水)=150:150:700]20mL及二苯胺磺酸钠指示液(0.5%的水溶液)5~7滴,用重铬酸钾标准溶液滴定至紫色保持30s不变,即为终点。2)计算:式中:V——耗用K2Cr2O7标准溶液的体积,mL;c——K2Cr2O7标准液的量浓度,mol/L;79.85——Fe2O3的摩尔质量,g/mol;m——试样质量,g。(2)颜料色光测定测定工具:4#调墨油(亚麻仁油制),描图纸,刮刀(长178mm、宽7~18mm),玻璃板,针筒。用千分之一精度的天平准确称取试样与标准样各1g,分别置于干净的玻璃板上。用针筒抽取0.8mL调墨油(或称0.6g),用刮刀将样品与油仔细调和,再用刮片用力刮使其成均匀之墨浆,直至无细粒存在。再将标准样用同法调成墨浆,用刮刀分别挑取标准样与产品墨浆少许,涂于描图纸上,两者相距约1cm,用刮片均匀刮下,在室内朝北散射光线下比较色泽的差异。色光差异的分级为:近似、微、稍、较四级。毒性防护及贮运:非危险品。存放于干燥处,以防止受潮。与酸、碱性物品隔离。食品添加剂最大允许使用量最大允许残留量标准▼▲添加剂中文名称允许使用该种添加剂的食品中文名称添加剂功能最大允许使用量(g/kg)最大允许残留量(g/kg)氧化铁食品食品工业用加工助剂/一般应在制成最后成品之前出去,有规定食品中残留量的除外用途主要用作磁性材料、颜料、擦光剂、催化剂等,还用于电讯、仪表工业类别自燃物品可燃性危险特性空气中易自燃;遇氧化剂放出硫化氢、二氧化硫、氰化氢等有毒气体储运特性库房通风低温干燥;与酸、氧化剂分开存放灭火剂雾状水、砂土、泡沫 |
| 结构式: |
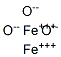 |
 |
|
声明:以上信息未经本网证实,仅供参考,华夏化工网不承担任何风险责任. |
|